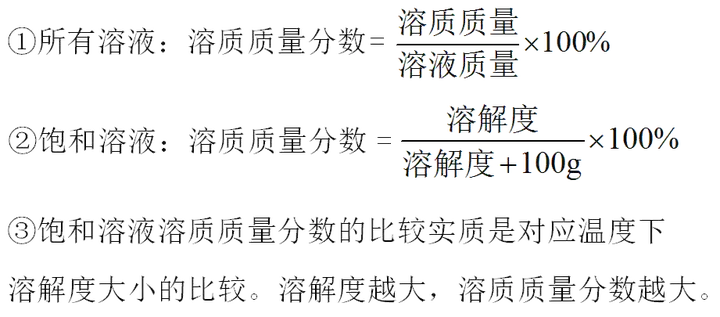-1-
“ئك×ى°ثةà”صf؟¼اé
،ِ êƒخ÷ضذ؟¼صf£؛±ط؟¼�،£¶àزشبـ½â¶باْ¾€½Y(ji¨¦)؛دŒچ(sh¨ھ)خï²ظ×÷ˆD»ٍصك±ي¸ٌذخت½أüî}����£¬أ؟ؤê؟¼²éµؤذخت½¾ù²»دàح¬،£½ü4 ؤê¾ùشع18î}î}خ»؟¼²é��،£
،ِ ة½خ÷ضذ؟¼صf£؛ƒH2017ؤêخ´؟¼،£³2014ؤê(بـ½â¶ب±ي)��،¢2011ؤê(1—lاْ¾€+Œچ(sh¨ھ)خï²ظ×÷ˆD)حâ��£¬ئنسà¾ùتا؟¼²é2·Nخ´ضھخïظ|(zh¨¬)µؤبـ½â¶باْ¾€،£ƒH2016ؤêشعŒچ(sh¨ھ)ٍ(y¨¤n)ج½¾؟î}ضذ؟¼²é���£¬ئنسà¾ùشعجî؟صî}ضذ؟¼²é��،£
،ِ ؛سؤدضذ؟¼صf£؛±ط؟¼،£ ³2015ؤê(بـ½â¶ب±ي)��،¢2010ؤê(ز»·Nخ´ضھخïظ|(zh¨¬)µؤبـ½â¶باْ¾€)£¬ئنسà¾ùتا؟¼²éƒة·Nخ´ضھخïظ|(zh¨¬)µؤبـ½â¶باْ¾€،£
،ِ ؛س±±ضذ؟¼صf£؛ƒH2010ؤêخ´؟¼����،£³£شعكx“ٌî}ضذزشبـ½â¶باْ¾€µؤذخت½كM(j¨¬n)ذذ؟¼²é��£¬إ¼ –ز²•زشخؤ×ضأèتِ»ٍبـ½â¶ب±ي¸ٌµؤذخت½كM(j¨¬n)ذذ؟¼²é،£
،ِ شئؤدضذ؟¼صf£؛±ط؟¼�����،£شعكx“ٌî}،¢جî؟صإc؛†´ًضذ¾ùسذةو¼°��،£¶àزشب—l»ٍƒة—lاْ¾€µؤذخت½؟¼²é���£¬µ«تاإ¼ –ز²•زشز»—lاْ¾€µؤذخت½؟¼²éدàêP(gu¨،n)ضھ×R����،£
،ِ °²»صضذ؟¼صf£؛±ط؟¼�،£؟¼²éذخت½¶àکس£¬؟¼²éز»—lاْ¾€•r�£¬اْ¾€×ك„فسذ“ض»ةدة؛حدبة؛َ½µ”ذح;؟¼²éƒة—lاْ¾€•r£¬اْ¾€×ك„فسذ“2ة”،¢“1ة1½µ”؛ح“2½µ”ذح��،£
،ِ ½خ÷ضذ؟¼صf£؛±ط؟¼��،£ اْ¾€µؤذخت½°üہ¨“1 ة 1 ½µ”����،¢“2ة”���،¢“2ة1½µ”µب،£ز²•زشاْ¾€½Y(ji¨¦)؛د±ي¸ٌذخت½���£¬»ٍ†خھڑ(d¨²)زش²ظ×÷ˆDµؤذخت½؟¼²é،£
-2-
صfپيصfب¥ك€µأ¾ڑ
1. (حئث]شئؤد،¢°²»ص،¢½خ÷���،¢؛س±±) ¼×،¢ززƒة¹جَwخïظ|(zh¨¬)µؤبـ½â¶باْ¾€بçˆDثùت¾£¬دآءذصf·¨هeص`µؤتا( )
¼×،¢ززƒةخïظ|(zh¨¬)µؤبـ½â¶ب¾ùëSœط¶بµؤة¸ك¶ّشِ´َ
t1،و•r£¬¼×خïظ|(zh¨¬)µؤبـ½â¶ب؛حززخïظ|(zh¨¬)µؤبـ½â¶بدàµب
t1،و•r�£¬¼×خïظ|(zh¨¬)؛حززخïظ|(zh¨¬)µؤï–؛حبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)¾ùé30%
t2،و•r£¬ززخïظ|(zh¨¬)µؤï–؛حبـز؛½µœط؛َ•سذ¾§َwخِ³ِ
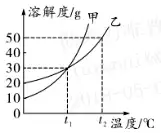
2. (حئث]؛سؤد���،¢؛س±±) a����،¢bƒةخïظ|(zh¨¬)شع²»ح¬œط¶ب•rµؤبـ½â¶ببç±يثùت¾£¬¸ù“(j¨´)±يضذذإد¢���£¬إذ”àدآءذصf·¨²»ص´_µؤتا ( )
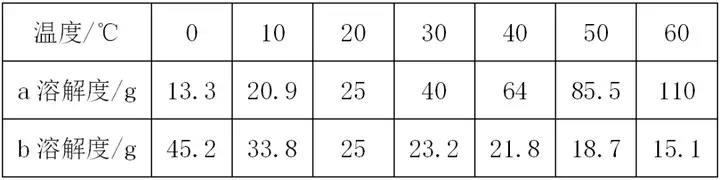
20،و•r��£¬دٍ100 gث®ضذ¼سبë25 g¹جَwa£¬ثùµأبـز؛ظ|(zh¨¬)ء؟تا125 g
bخïظ|(zh¨¬)µؤبـ½â¶بëSœط¶بµؤة¸ك¶ّœpذ،
50،و•r£¬100 g bخïظ|(zh¨¬)µؤï–؛حبـز؛ضذسذ
18.7 g bخïظ|(zh¨¬)
Œ¢30،و•r£¬a��،¢bƒةخïظ|(zh¨¬)µؤï–؛حبـز؛ح¬•r½µœطضء20،و�����£¬ثùµأبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)µؤ´َذ،êP(gu¨،n)دµتاa>b
3. (حئث]شئؤد�،¢°²»ص) بçˆDتاز»·N¹جَwخïظ|(zh¨¬)(²»؛¬½Y(ji¨¦)¾§ث®)µؤبـ½â¶باْ¾€،£ دآءذصf·¨هeص`µؤتا( )
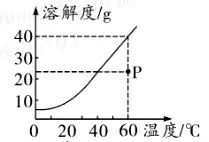
60،و•rش“خïظ|(zh¨¬)µؤبـ½â¶بé40 g
ش“خïظ|(zh¨¬)µؤبـ½â¶بëSœط¶بµؤة¸ك¶ّœpذ،
Püc(di¨£n)±يت¾60،و•rش“خïظ|(zh¨¬)µؤ²»ï–؛حبـز؛
؟ةزشح¨ك^½µœط½Y(ji¨¦)¾§µؤ·½·¨جل¼ƒش“خïظ|(zh¨¬)
4. (حئث]½خ÷) A����،¢B��،¢Cب·Nخïظ|(zh¨¬)µؤبـ½â¶باْ¾€بçˆDثùت¾£¬صˆ»ط´ًدآءذ†–î}،£
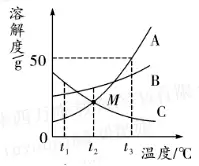
(1)t1،و•r��£¬ A���،¢B����،¢Cب·Nخïظ|(zh¨¬)µؤبـ½â¶بسة´َµ½ذ،µؤيکذٍتا______،£
(2)t3،و•r°ر50g A ·إبë50gث®ضذµأµ½Aµؤ______(جî“ï–؛ح”»ٍ“²»ï–؛ح”)بـز؛£¬´ث•rبـز؛ضذبـظ|(zh¨¬)؛حبـز؛µؤظ|(zh¨¬)ء؟±بé______�،£
(3)Œ¢t3،و •r£¬A،¢B،¢Cب·Nخïظ|(zh¨¬)µؤï–؛حبـز؛½µœطضءt2،و,ثùµأبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)µؤ´َذ،êP(gu¨،n)دµتا______،£
5. (حئث]êƒخ÷) بçˆDتادُثلâ›؛حآب»¯âcشع²»ح¬œط¶ب•rµؤبـ½â¶باْ¾€�£¬دآ±يتاƒة·Nخïظ|(zh¨¬)شع²؟·ضœط¶ب•rµؤبـ½â¶ب”µ(sh¨´)“(j¨´)����،£
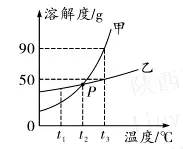
(1)¸ù“(j¨´)بـ½â¶ب±ي¸ٌ؟ةضھ����£¬بـ½â¶باْ¾€ˆDضذ¼×±يت¾_______µؤبـ½â¶باْ¾€�����،£
(2)بô¼×خïظ|(zh¨¬)ضذ»ىسذةظء؟µؤززخïظ|(zh¨¬)��£¬جل¼ƒ¼×خïظ|(zh¨¬)×î؛أ²ةب،µؤ·½·¨تا____(جî“ ½µœط½Y(ji¨¦)¾§”»ٍ“ صô°l(f¨،)½Y(ji¨¦)¾§”)����،£
(3)Œ¢t1،و µؤ¼×�����،¢ززƒةخïظ|(zh¨¬)µؤï–؛حبـز؛(¾ùںo¹جَwخïظ|(zh¨¬)ت£سà) ةœطµ½t2،و •r£¬ثùµأ¼×خïظ|(zh¨¬)بـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)____(جî“´َسع”���،¢“ذ،سع”»ٍ“µبسع”)ززخïظ|(zh¨¬)بـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)�،£
6. (حئث]½خ÷) t1،و•r����£¬Œ¢µبظ|(zh¨¬)ء؟µؤ¼×��،¢ززƒة·N¹جَwخïظ|(zh¨¬)£¬·ض„e¼سبëµ½ت¢سذ100 gث®µؤں±ضذ£¬³ن·ض?j¨«n)‡°è؛َ¬F(xi¨¤n)دَبçˆD1��£¬¼سںلضءt2،و•r¬F(xi¨¤n)دَبçˆD2����،£¼×��،¢زز�،¢±ûب·Nخïظ|(zh¨¬)µؤبـ½â¶باْ¾€بçˆD3،£ صˆ½Y(ji¨¦)؛دˆDت¾»ط´ًدآءذ†–î}£؛
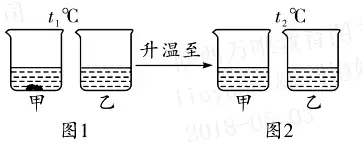
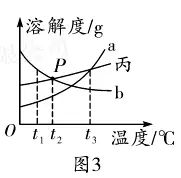
(1)·ضخِˆD1؛حˆD2ضذµؤ¬F(xi¨¤n)دَ�����£¬إذ”à·û؛د¼×خïظ|(zh¨¬)µؤبـ½â¶باْ¾€تاˆD3ضذµؤ____(كxجî“a”»ٍ“b”);ˆDضذPüc(di¨£n)±يت¾µؤ؛¬ءxتا______���،£
(2)t1،و•r�£¬¼×،¢زز����،¢±ûµؤï–؛حبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)ڈؤذ،µ½´َµؤيکذٍتا_____���،£
(3)t3،و•r£¬Œ¢µبظ|(zh¨¬)ء؟µؤ¼×�،¢زز��،¢±ûµؤï–؛حبـز؛½µœطµ½t1،و�£¬ز»¶¨سذ¾§َwخِ³ِµؤتا _____ ،£
7. (حئث]êƒخ÷) دآ±يتا a��،¢bƒةخïظ|(zh¨¬)شع²»ح¬œط¶ب•rµؤبـ½â¶ب�£¬·ضخِ±يضذ”µ(sh¨´)“(j¨´)����£¬»ط´ً†–î}���،£
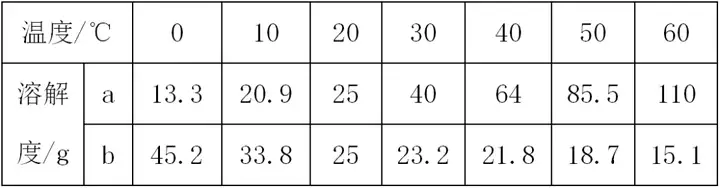
(1)20،و•r��£¬دٍ 50 gث®ضذ¼سبë25 gµؤ¹جَwa�����£¬ثùµأبـز؛ظ|(zh¨¬)ء؟تا_____g،£
(2)Œ¢30،و•r��£¬a،¢bƒةخïظ|(zh¨¬)µؤï–؛حبـز؛ح¬•rةœطضء40،و�£¬ثùµأبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)µؤ´َذ،êP(gu¨،n)دµتاa____b(جî“>”�،¢“<”»ٍ“=”)،£
(3)بçˆDثùت¾����£¬¬F(xi¨¤n)سذ20،و•rµبظ|(zh¨¬)ء؟µؤa�،¢bƒةخïظ|(zh¨¬)µؤï–؛حبـز؛����£¬دٍں±µؤث®ضذ¼سبëز»¶¨ء؟µؤدُثلن@��£¬بـ½â؛َ¼×ش‡¹ـƒب(n¨¨i)³ِ¬F(xi¨¤n)µؤ¬F(xi¨¤n)دَتا_____;ززش‡¹ـƒب(n¨¨i)µؤبـز؛تا_____(جî“ï–؛ح”»ٍ“²»ï–؛ح”)بـز؛�����،£
،¾´ً°¸،؟
1.C 2.C 3.B
4.(1)C>B>A (2)ï–؛ح 1:3
(3)B>A>C
5.(1)دُثلâ›(»ٍKNO3) (2)½µœط½Y(ji¨¦)¾§
(3)ذ،سع
6.(1)a t2،و•r£¬زز؛ح±ûµؤبـ½â¶بدàµب
(2)¼× < ±û < زز
(3)¼×؛ح±û
7.(1)62.5 (2)>
(3)سذ¾§َwخِ³ِ ²»ï–؛ح
-3-
Œ£¼زأطصذعs¾o؟´
ز»�����،¢بـ½â¶باْ¾€
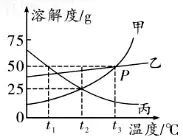
زھüc(di¨£n)1£؛بـ½â¶بëSœط¶بµؤ׃»¯ع…„ف
✪
بç£؛¼×����،¢ززµؤبـ½â¶ب¾ùëSœط¶بµؤة¸ك¶ّشِ´َ����£¬±ûµؤبـ½â¶بëSœط¶بµؤة¸ك¶ّœpذ، ���،£
،ِ ·½·¨ض¸Œ§(d¨£o)£؛؟´اْ¾€µؤئآ¶ب¼°×كدٍ�£¬ڈؤ×َµ½سز؟´اْ¾€µؤ×ك„فتادٍةد،¢دٍدآك€تائ½¾ڈ���،£دٍةد±يت¾ëSœط¶بة¸كبـ½â¶بشِ´َ(بç¼×�����،¢زز);ئ½¾ڈ±يت¾ëSœط¶بة¸كبـ½â¶بشِ´َµؤع…„ف²»ï@ضّ(بçزز);دٍدآ±يت¾ëSœط¶بة¸كبـ½â¶بœpذ،(بç±û)����،£
زھüc(di¨£n)2£؛ بـ½â¶باْ¾€½»üc(di¨£n)µؤ؛¬ءx
✪
بç£؛Püc(di¨£n)±يت¾£؛t3،و•r�����£¬¼×���،¢ززµؤبـ½â¶بدàµب£¬¾ùé50 g ����،£
،ِ ·½·¨ض¸Œ§(d¨£o)£؛اْ¾€½»üc(di¨£n)±يت¾ش“œط¶ب•r£¬ƒة·Nخïظ|(zh¨¬)µؤبـ½â¶بدàµب�£¬´ث•rƒة·Nخïظ|(zh¨¬)ï–؛حبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)ز²دàح¬��،£أèتِƒة—lبـ½â¶باْ¾€½»üc(di¨£n)ثù±يت¾µؤزâءx•rزھض¸أ÷œط¶ب،£
زھüc(di¨£n)3£؛بـ½â¶ب´َذ،µؤإذ”àإc±بف^
✪
بç£؛t1،و•r��£¬ب·Nخïظ|(zh¨¬)µؤبـ½â¶بسة´َµ½ذ،µؤيکé£؛±û>زز>¼× ����،£
،ِ ·½·¨ض¸Œ§(d¨£o)£؛خïظ|(zh¨¬)بـ½â¶ب´َذ،µؤ±بف^ëx²»é_œط¶ب�،£ك^ش“œط¶بŒ¦‘ھ(y¨©ng)µؤüc(di¨£n)×÷´¹ض±سع™MفSµؤض±¾€���£¬؟´ض±¾€Œ¦‘ھ(y¨©ng)µؤ½»üc(di¨£n)µؤ؟v×ّکث(bi¨،o)£؛¢ظش“؟v×ّکث(bi¨،o)é´ثœط¶بدآŒ¦‘ھ(y¨©ng)خïظ|(zh¨¬)µؤبـ½â¶ب����،£¢علکŒ¦ƒة·N»ٍƒة·Nزشةدخïظ|(zh¨¬)بـ½â¶ب´َذ،µؤ±بف^�£¬؟v×ّکث(bi¨،o)ش½´َ£¬بـ½â¶بش½´َ����،£
زھüc(di¨£n)4£؛ï–؛حبـز؛إc²»ï–؛حبـز؛µؤإذ”༰د໥قD(zhu¨£n)»¯
✪
بç£؛¢ظt1،و•r£¬Œ¢25 g¼×خïظ|(zh¨¬)¼سبëµ½100 gث®ضذ����£¬ا،؛أذخ³ة¼×µؤï–؛حبـز؛��،£¢ع¼×µؤï–؛حبـز؛ةœط؛َ׃³ة²»ï–؛حبـز؛����،£
،ِ ·½·¨ض¸Œ§(d¨£o)£؛
شعز»¶¨œط¶بدآ£؛

ï–؛حبـز؛إc²»ï–؛حبـز؛µؤقD(zhu¨£n)»¯£؛
¢ظبـ½â¶بëSœط¶بµؤة¸ك¶ّشِ´َ�£¬„t

¢عبـ½â¶بëSœط¶بµؤة¸ك¶ّœpذ،£¬„t

✪ زھüc(di¨£n)5£؛ بـز؛بـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)µؤس‹ثمإc±بف^
بç£؛t1،و•r£¬Œ¢40 g±û¼سبëµ½100 gث®ضذ����£¬³ن·ضبـ½â,ثùµأبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)é28.6%;t2،و•r����£¬¼×µؤï–؛حبـز؛µؤبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)é20% �����،£
،ِ ·½·¨ض¸Œ§(d¨£o)£؛س‹ثم¹«ت½ذèض”(j¨«n)س›£؛
زھüc(di¨£n)6£؛إذ”àخïظ|(zh¨¬)½Y(ji¨¦)¾§µؤ·½·¨
✪

زھüc(di¨£n)7£؛ œط¶ب¸ؤ׃•r�£¬بـز؛ضذ¸÷·Nء؟µؤ׃»¯اé›r
✪
بç£؛t3،و•r����£¬Œ¢دàح¬ظ|(zh¨¬)ء؟µؤ¼×،¢زز����،¢±ûµؤï–؛حبـز؛ح¬•r½µœطµ½t1،و����£¬„tدآءذصf·¨ص´_µؤتا(C )
A. بـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)£؛زز<±û
B. بـ„©ظ|(zh¨¬)ء؟£؛¼×>زز
C. بـظ|(zh¨¬)ظ|(zh¨¬)ء؟£؛زز>±û
D. بـز؛ظ|(zh¨¬)ء؟£؛¼×>±û
،ِ ·½·¨ض¸Œ§(d¨£o)£؛ï–؛حبـز؛œط¶ب׃»¯•r£؛
(1)خïظ|(zh¨¬)µؤبـ½â¶بëSœط¶بµؤة¸ك¶ّشِ´َ(¼´اْ¾€éةدةذح)،£
¢ظ بôŒ¢ï–؛حبـز؛½µµحœط¶ب£¬سةسعخِ³ِ¾§َw�����£¬بـز؛ضذبـظ|(zh¨¬)ظ|(zh¨¬)ء؟œpذ،����£¬بـ„©ظ|(zh¨¬)ء؟²»×ƒ£¬بـز؛ظ|(zh¨¬)ء؟œpذ،�����£¬زٍ´ثبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)׃ذ،�����،£
¢ع بôŒ¢ï–؛حبـز؛ة¸كœط¶ب�����£¬ï–؛حبـز؛׃?y¨u)é²»ï–؛حبـز؛��£¬بـز؛ضذبـظ|(zh¨¬)��،¢بـ„©ظ|(zh¨¬)ء؟¾ù²»×ƒ�£¬زٍ´ثبـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)ز²²»×ƒ،£
(2)خïظ|(zh¨¬)µؤبـ½â¶بëSœط¶بة¸ك¶ّœpذ،(¼´اْ¾€éدآ½µذح)����،£¸ؤ׃œط¶ب•r����£¬بـز؛ضذبـظ|(zh¨¬)��،¢بـ„©����،¢بـز؛µؤظ|(zh¨¬)ء؟��£¬بـظ|(zh¨¬)ظ|(zh¨¬)ء؟·ض?j¨«n)?sh¨´)׃»¯اé›rإcةدتِ·ضخِدà·´��،£
¶���،¢بـ½â¶باْ¾€
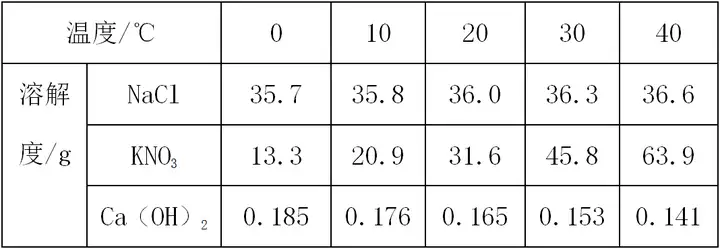
زھüc(di¨£n)1£؛ڈؤ±يضذض±½س×xب،ذإد¢
✪
(1)ح¬ز»خïظ|(zh¨¬)��£¬²»ح¬œط¶بدآµؤبـ½â¶ب���،£
بçآب»¯âcشع10،و•rبـ½â¶بé35.8g�����£¬شع30،و•rبـ½â¶بé36.3g،£
(2)²»ح¬خïظ|(zh¨¬)��£¬شعح¬ز»œط¶بدآµؤبـ½â¶ب�����،£
بç20،و•r�����£¬آب»¯âcµؤبـ½â¶بé36.0 g����£¬دُثل⛵ؤبـ½â¶بé31.6g��£¬ڑنرُ»¯â}µؤبـ½â¶بé0.165 g���،£
(3)¸ù“(j¨´)²»ح¬œط¶بدآبـ½â¶بµؤ׃»¯اé›r���£¬إذ”àخïظ|(zh¨¬)µؤبـ½â¶بëSœط¶بµؤ׃»¯ع…„ف،£ بçآب»¯âcµؤبـ½â¶ب׃»¯ع…„فéëSœط¶بة¸ك�����£¬بـ½â¶بشِ´َ����£¬µ«تا·ù¶بف^ذ،;دُثل⛵ؤبـ½â¶ب׃»¯ع…„فéëSœط¶بة¸كشِéL·ù¶بف^´َ;ڑنرُ»¯â}µؤبـ½â¶ب׃»¯ع…„فéëSœط¶بشِ´َ¶ّœpذ، ،£(ƒH׃»¯ع…„ف����،¢²»×ِ”µ(sh¨´)“(j¨´)Œ¦±ب)
زھüc(di¨£n)2£؛بـ½â¶ب±يµؤ‘ھ(y¨©ng)سأ
✪
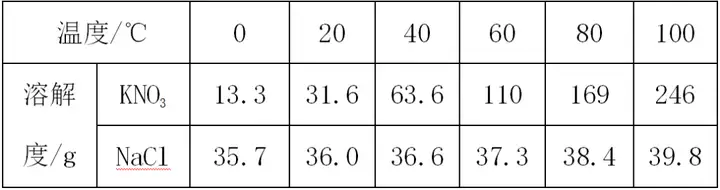
زش±ي¸ٌ”µ(sh¨´)“(j¨´)ذخت½؟¼²éƒة·Nخïظ|(zh¨¬)(بçNaCl؛حKNO3)بـ½â¶بدàµبµؤœط¶ب·¶‡ْé20،و،« 30،و ،£
،ِ ·½·¨ض¸Œ§(d¨£o)£؛¸ù“(j¨´)بـ½â¶ب±ي,ح¨ك^Œ¦±بƒة·Nخïظ|(zh¨¬)µؤبـ½â¶ب�£¬20،وزشا°£¬NaClµؤبـ½â¶ب´َسعKNO3�£¬30،وزش؛َ����£¬NaClµؤبـ½â¶بذ،سعKNO3�����£¬„tNaCl؛حKNO3 بـ½â¶بدàµبµؤœط¶ب·¶‡ْز»¶¨شع20،و،« 30،وض®ég�����،£
،،،، ڑgست¹سأتض™C(j¨©)���،¢ئ½°هµبزئ„سشO(sh¨¨)‚نشL†–ضذ؟¼¾W(w¨£ng)��£¬2024ضذ؟¼ز»آ·إم°éح¬ذذ��£،>>üc(di¨£n)“ô²é؟´