âcž°ÆäŧŊšÏÎï
ŌŧĄĒâcĩÄÎïĀíÐÔŲ|(zhĻŽ)
1.îÉŦĢšãy°ŨÉŦ�����ĄĒÓÐ―ðŲđâÉ�����ĄĢ
2.ÃÜķČĢšâcĄĒËŪšÍÚÓÍĩÄÃÜķČīóÐĄéρ(ËŪ)>ρ(âc)>ρ(ÚÓÍ)���ĄĢ
3.ČÛüc(diĻĢn)ĢšÐĄÓÚ(Ėî“īóÓÚ”“ÐĄÓÚ”ŧō“ĩČÓÚ”)100 ĄæĄĢ
4.ÓēķČĢšŲ|(zhĻŽ)ĩØÝ^Ü����ĄĢ
ķþ�����ĄĒÄÔŨÓ―Y(jiĻĶ)(gĻ°u)ÕJ(rĻĻn)ŨR(shĻŠ)âcĩÄŧŊW(xuĻĶ)ÐÔŲ|(zhĻŽ)——ßÔÐÔ

1.âcÅc·Į―ðŲÎŲ|(zhĻŽ)·īŠ(yĻĐng)
(1)ÅcO2·īŠ(yĻĐng)
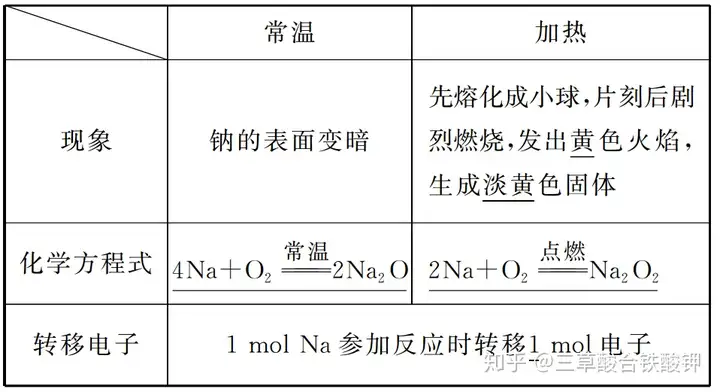
(2)ÅcCl2·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―Ģš2Na+Cl2üc(diĻĢn)Čž(=====)2NaCl��ĄĢ
(3)ÅcS·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―Ģš2Na+SĄũ(=====)Na2S����ĄĢ
2.âcÅcËŪ�ĄĒû}ČÜŌšĩÄ·īŠ(yĻĐng)
(1)âcÅcËŪĩÄ·īŠ(yĻĐng)
ĒŲâcÅcËŪ·īŠ(yĻĐng)ĩÄëxŨÓ·―ģĖĘ―Ģš2Na+2H2O===2Na++2OH-+H2↑ĄĢ
ĒÚâcÅcËŪ(šŽ·ÓĖŠ)·īŠ(yĻĐng)ĩÄ(shĻŠ)ō(yĻĪn)ŽF(xiĻĪn)Ïóž°―âáĢš

(2)âcÅcû}ČÜŌšĩÄ·īŠ(yĻĐng)
NaÏČšÍËŪ·īŠ(yĻĐng)ÉúģÉNaOHÔŲÅcû}ČÜŌš·īŠ(yĻĐng)�ĢŽēĒÅÐāĘĮ·ņ°l(fĻĄ)ÉúÍ(fĻī)·Ö―â·īŠ(yĻĐng)
ČįâcÍķČëCuSO4ČÜŌšÖÐ�ĢŽ·īŠ(yĻĐng)ĩÄëxŨÓ·―ģĖĘ―é2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑���ĄĢ
âcÍķČëBaCl2ČÜŌšÖÐĢŽ·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―é2Na+2H2O===2NaOH+H2↑���ĄĢ
3.âcÅcû}ËáĩÄ·īŠ(yĻĐng)
âcÅcû}Ëá·īŠ(yĻĐng)ĩÄëxŨÓ·―ģĖĘ―é2Na+2H+===2Na++H2↑
ČýĄĒâcĩÄÖÆČĄ��ĄĒąĢīæž°ÓÃÍū
1.ÖÆČ��ĄĢšŧŊW(xuĻĶ)·―ģĖĘ―é2NaCl(ČÛČÚ)ÍĻë(=====)2Na+Cl2↑���ĄĢ
2.ąĢīæĢšÃÜ·âąĢīæ���ĢŽÍĻģĢąĢīæÔÚĘŊÏÓÍŧōÚÓÍÖÐĄĢ
3.ÓÃÍū
(1)âcĄĒâšÏ―ð(ŌšB(tĻĪi))ŋÉÓÃÓÚÔŨÓ·īŠ(yĻĐng)ķŅĩħ(dĻĢo)áĐĄĢ
(2)Ũũ(qiĻĒng)ßÔĐ����ĢŽĒÄģÐĐÏĄÓÐ―ðŲ?gĻ°u)ÄËüĩÄûuŧŊÎïÖÐßÔģöí(lĻĒi)��ĢŽČį4Na+TiCl4ČÛČÚ(=====)Ti+4NaCl�����ĄĢ
(3)ÓÃŨũëđâÔīĢŽÖÆŨũļßšâcô�ĄĢ
ËÄ�ĄĒŅõŧŊâcÅcß^(guĻ°)ŅõŧŊâcĩÄąČÝ^
ŋ―Y(jiĻĶ)
1.âcĩÄČĄÓ÷―·ĻĢšÓÃčŨÓAČĄŌŧÐĄKâcĢŽÓÃVžÎüļÉąíÃæĩÄÚÓÍ�ĢŽÓÃÐĄĩķĮÐČĄüSķđīóÐĄĩÄâc�����ĢŽĘĢÓāĩÄâc·ÅŧØÔĐÆŋ��ĄĢ
2.âcʧŧðĩÄĖĀíĢšÉģÍÁÉwį���ĢŽēŧÄÜÓÃËŪŧōÅÝÄįŧðÆũįŧðĄĢ
3.Na2O2ÖÐŅõÔŠËØĩÄŧŊšÏr(jiĻĪ)é-1r(jiĻĪ)ķøēŧĘĮ-2r(jiĻĪ)���ĄĢ
4.Na2O2ū§ówÖÐę����ĄĒę(yĻĒng)ëxŨÓ(gĻĻ)ĩ(shĻī)ąČé1ĄÃ2ķøēŧĘĮ1ĄÃ1ĄĢ
5.ß^(guĻ°)ŅõŧŊâcÅcßÔÐÔČÜŌš·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―ĩÄøē―óEĢš
ĩÚŌŧē―ĢšNa2O2ÅcČÜŌšÖÐĩÄËŪ·īŠ(yĻĐng)ÉúģÉNaOHšÍO2;
ĩÚķþē―Ģš·īŠ(yĻĐng)ÉúģÉĩÄO2ÅcßÔÐÔû}°l(fĻĄ)ÉúŅõŧŊßÔ·īŠ(yĻĐng);
ĩÚČýē―ĢšĒÉÏĘöÉ(gĻĻ)·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―šÏēĒ����ĢŽžīĩÃŋĩÄŧŊW(xuĻĶ)·―ģĖĘ―ĄĢ
6.Na2O2ÅcH2O��ĄĒCO2·īŠ(yĻĐng)ĩÄÉ(gĻĻ)ģĢŌ(jiĻĪn)Õ`
^(qĻą)
(1)Na2O2ÅcH2O����ĄĒCO2·īŠ(yĻĐng)ķžĘĮŨÔÉíĩÄŅõŧŊßÔ·īŠ(yĻĐng);
(2)1 mol Na2O2ÅcŨãÁŋCO2ŧōH2O°l(fĻĄ)Éú·īŠ(yĻĐng)r(shĻŠ)ĢŽÞD(zhuĻĢn)ŌÆĩÄëŨÓĩ(shĻī)ĘĮNAķøēŧĘĮ2NA����ĄĢ
1.―ðŲâcÅcû}ŧōAČÜŌš·īŠ(yĻĐng)ĩÄËžūSÄĢ°å

2.―ðŲâcÅcČÜŌš·īŠ(yĻĐng)ŽF(xiĻĪn)Ïó·ÖÎöËžūSÄĢ°å
(1)đēÐÔĢšŌō?yĻĪn)éâcÅcēŧÍŽĩÄËŪČÜŌš·īŠ(yĻĐng)ūųŲÓÚĄÁŌĩÄÖÃQ·īŠ(yĻĐng)ĢŽđĘÓÐđēÍŽĩÄŽF(xiĻĪn)ÏóŪa(chĻĢn)ÉúĢšĒŲļ����ĄĢšâcļĄÔÚŌšÃæÉÏ;ĒÚČÛĢšâcČÛŧŊģÉđâÁÁĩÄÐĄĮō;ĒÛÓÎĢšÔÚŌšÃæÉÏēŧÍĢĩØÓÎÓ(dĻ°ng)ÖąÖÁ·īŠ(yĻĐng)Íę;ĒÜíĢš·īŠ(yĻĐng)ÖÐēŧÍĢĩØ°l(fĻĄ)ģö“ËŧËŧ”ĩÄíÂĄĢ
(2)ēîŪÐÔĢšÅcËá���ĄĒ(qiĻĒng)ËáČõAû}ČÜŌš·īŠ(yĻĐng)r(shĻŠ)����ĢŽÓÉÓÚČÜŌšÖÐH+âķČÝ^īóĢŽ·īŠ(yĻĐng)ąČÅcËŪßŌŠ?jiĻĢng)ĄÁŌ��ĢŽŨîšóâcŋÉÄÜÔÚŌšÃæÉÏČžý;Åcû}ČÜŌš·īŠ(yĻĐng)r(shĻŠ)�����ĢŽßŋÉÄÜþ(huĻŽ)ÉúģÉģÁĩí(ČįÉúģÉëyČÜA)��ĄĒâów(NH3)ĩČ��ĄĢ
1.âcÅcŅõâ·īŠ(yĻĐng)ĩÄŪa(chĻĢn)ÎïÅc·īŠ(yĻĐng)ØķČÓÐęP(guĻĄn)�ĢŽžÓáŧōüc(diĻĢn)ČžŪa(chĻĢn)ÎïĘĮß^(guĻ°)ŅõŧŊâc���ĄĢ
2.ēŧđÜÉúģÉŅõŧŊâcßĘĮß^(guĻ°)ŅõŧŊâc�ĢŽ―ðŲâcʧëŨÓūųŨ?yĻu)?1r(jiĻĪ)ĩÄę(yĻĒng)ëxŨÓ��ĢŽŌōķøĩČÁŋĩÄâcÍęČŦ·īŠ(yĻĐng)ʧČĨĩÄëŨÓĩ(shĻī)ÏāÍŽ
1.ÓÐęP(guĻĄn)Na2O2ÅcCO2�ĄĒH2OĩÄ·īŠ(yĻĐng)ĩÄŨ(gĻĻ)ÖØŌŠęP(guĻĄn)Ïĩ
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(1)ÎïŲ|(zhĻŽ)ĩÄÁŋĩÄęP(guĻĄn)Ïĩ
o(wĻē)ÕĘĮCO2ŧōH2OĩÄÎŌŧÎïŲ|(zhĻŽ)ßĘĮķþÕßĩÄŧėšÏÎïĢŽÍĻß^(guĻ°)ŨãÁŋĩÄNa2O2r(shĻŠ)����ĢŽCO2ŧōH2OÅc·ÅģöO2ĩÄÎïŲ|(zhĻŽ)ĩÄÁŋÖŪąČūųé2ĄÃ1���ĄĢ
(2)âówów·eęP(guĻĄn)Ïĩ
ČôCO2šÍËŪÕôâĩÄŧėšÏâów(ŧōÎŌŧâów)ÍĻß^(guĻ°)ŨãÁŋNa2O2ĢŽâówów·eĩÄpÉŲÁŋĩČÓÚÔŧėšÏâówów·eĩÄ2(1)ĮŌĩČÓÚÉúģÉŅõâĩÄów·e�ĄĢ
(3)ëŨÓÞD(zhuĻĢn)ŌÆęP(guĻĄn)Ïĩ
Ū(dĻĄng)Na2O2ÅcCO2ĄĒH2O·īŠ(yĻĐng)r(shĻŠ)��ĢŽÎïŲ|(zhĻŽ)ĩÄÁŋęP(guĻĄn)Ïĩé2Na2O2ĄŦO2ĄŦ2e-����ĄĢ
(4)đĖówŲ|(zhĻŽ)ÁŋęP(guĻĄn)Ïĩ
ÏāŪ(dĻĄng)ÓÚđĖów(Na2O2)ÖŧÎüĘÕÁËCO2ÖÐĩÄ“CO”ĢŽH2OÖÐĩÄ“H2”;ŋÉŌÔŋīŨũ°l(fĻĄ)ÉúÏāŠ(yĻĐng)ĩÄ·īŠ(yĻĐng)ĢšNa2O2+CO===Na2CO3����ĄĒNa2O2+H2===2NaOH((shĻŠ)ëHÉÏÉ·īŠ(yĻĐng)ēŧÄÜ°l(fĻĄ)Éú)ĄĢ
(5)ÏČšóíÐōęP(guĻĄn)Ïĩ
ŌŧķĻÁŋĩÄNa2O2ÅcŌŧķĻÁŋĩÄCO2šÍH2O(g)ĩÄŧėšÏÎïĩÄ·īŠ(yĻĐng)���ĢŽŋÉŌŨũNa2O2ÏČÅcCO2·īŠ(yĻĐng)���ĢŽīýCO2·īŠ(yĻĐng)ÍęģÉšóĢŽNa2O2ÔŲÅcH2O(g)°l(fĻĄ)Éú·īŠ(yĻĐng)�ĄĢ
2.ÔöÖØÁŋĩČÓÚŋÉČžÎïŲ|(zhĻŽ)ÁŋĩÄŌ(guĻĐ)ÂÉ
·ē·ÖŨÓ―MģÉ·ûšÏ(CO)m·(H2)nĩÄÎïŲ|(zhĻŽ)ĢŽWgÔÎïŲ|(zhĻŽ)ÔÚO2ÖÐÍęČŦČžý�����ĢŽĒÆäŪa(chĻĢn)Îï(CO2šÍËŪÕôâ)ÍĻß^(guĻ°)ŨãÁŋĩÄNa2O2šóĢŽđĖówÔöÖØąØéWg��Ą����ĢŧōĘĮÓÉCĄĒH�����ĄĒOČý·NÔŠËØ―MģÉĩÄÎïŲ|(zhĻŽ)�����ĢŽÖŧŌŠC�ĄĒOÔŨÓ(gĻĻ)ĩ(shĻī)ąČé1ĄÃ1�����ĢŽžīŋÉMŨãÔlžþ�ĄĢ
ÖÐW(xuĻĶ)ëAķÎģĢŌ(jiĻĪn)ĩÄ·ûšÏß@ŌŧęP(guĻĄn)ÏĩĩÄÎïŲ|(zhĻŽ)ÓÐĢš
(1)o(wĻē)C(jĻĐ)ÎïĢšH2ĄĒCOž°H2šÍCOĩÄŧėšÏâów�����ĄĢ
(2)ÓÐC(jĻĐ)ÎïĢšCH3OH(žŨīž)ĄĒHCHO(žŨČĐ)����ĄĒCH3COOH(ŌŌËá)ĄĒHCOOCH3(žŨËážŨõĨ)���ĄĒC6H12O6(ÆÏĖŅĖĮ)ĩČ�����ĄĢ
ß^(guĻ°)ŅõŧŊâcĩÄ(qiĻĒng)ŅõŧŊÐÔ
1.Na2O2ÅcSO2·īŠ(yĻĐng)ĢšNa2O2+SO2===Na2SO4���ĄĢ
2.Na2O2ÍķČëFeCl2ČÜŌšÖÐĢŽŋÉĒFe2+ŅõŧŊģÉFe3+��ĢŽÍŽr(shĻŠ)ÉúģÉFe(OH)3ģÁĩí����ĄĢ
3.Na2O2ÍķČëäÁōËáÖÐĢŽŋÉĒH2SŅõŧŊģÉÎŲ|(zhĻŽ)Áō��ĢŽČÜŌšŨá�ĄĢ
4.Na2O2ÍķČëNa2SO3ČÜŌšÖÐĢŽŋÉĒSO3(2-)ŅõŧŊģÉSO4(2-)ĄĢ
5.Na2O2ūßÓÐÆŊ°ŨÐÔ���ĢŽÍķČëÆ·žtČÜŌšÖÐ�����ĢŽŋÉĘđÆ·žtČÜŌšÍĘÉŦ
âcĩÄÖØŌŠŧŊšÏÎï
1.ĖžËáâcšÍĖžËáäâc

2.âcž°ÆäÖØŌŠŧŊšÏÎïégĩÄÞD(zhuĻĢn)ŧŊęP(guĻĄn)Ïĩ

DÖЧË(biĻĄo)Ė(hĻĪo)ĩÄÓÐęP(guĻĄn)·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―Ģš
ĒŲ2Na+O2üc(diĻĢn)ČžNa2O2;
ĒÚ2Na+2H2O===2NaOH+H2↑;
ĒÛ2Na2O2+2H2O===4NaOH+O2↑;
ĒÜ2Na2O2+2CO2===2Na2CO3+O2;
ĒÝ2NaOH+CO2===Na2CO3+H2O;
ĒÞ2NaCl+2H2Oë―â2NaOH+Cl2↑+H2↑���ĄĢ
3.Na2CO3ĩÄÖÆäž°ÓÃÍū
(1)Na2CO3ĩÄđĪI(yĻĻ)ÖÆä——šîĘÏÖÆA·Ļ
ĒŲÖÆäÔĀí
°ŅķþŅõŧŊĖžÍĻČë°ąĩÄÂČŧŊâcïšÍČÜŌšÖÐĢŽĘđČÜ―âķČÝ^ÐĄĩÄĖžËáäâcÄČÜŌšÖÐÎöģö�ĢŽß^(guĻ°)VĩÃĩ―ĖžËáäâcū§ówĢŽĖžËáäâcĘÜá·Ö―âÉúģÉĖžËáâc����ĄĢ
ĒÚ·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―
a.NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;
b.2NaHCO3Ąũ(=====)Na2CO3+CO2↑+H2O��ĄĢ
(2)Na2CO3�����ĄĒNaHCO3ĩÄÓÃÍū
ĒŲNa2CO3ĘĮŌŧ·N·ĮģĢÖØŌŠĩÄŧŊđĪÔÁÏ����ĢŽÔÚēĢÁ§ĄĒ·ĘÔíĄĒšÏģÉÏīėĐ�ĄĒÔėžĄĒžŋ���ĄĒĘŊÓÍ�ĄĒŌą―ð����ĄĒĘģÆ·ĩČđĪI(yĻĻ)ÖÐÓÐÖøV·šĩÄŠ(yĻĐng)ÓÃĄĢ
ĒÚNaHCO3ĘĮąšÖÆļâüc(diĻĢn)ËųÓÃĩÄ°l(fĻĄ)―Í·ÛĩÄÖũŌŠģÉ·ÖÖŪŌŧ;ÔÚát(yĻĐ)ŊÉÏ��ĢŽËüĘĮÖÎŊÎļËáß^(guĻ°)ķāĩÄŌŧ·NËĐ�ĄĢ
4.Na2CO3šÍNaHCO3ĩÄąČÝ^
(1)Na2CO3ĄĒNaHCO3ĩÄčbe
ĒŲČôéđĖów
ŋÉĀûÓÞÓá·Ļ����ĄĢžÓáŪa(chĻĢn)ÉúĘđģÎĮåĘŊŧŌËŪŨáĩÄâówĩÄĘĮNaHCO3ĄĢ
ĒÚČôéČÜŌš
ŋÉĀûÓÃģÁĩí·Ļ����ĄĢžÓČëBaCl2ČÜŌšĢŽŪa(chĻĢn)Éú°ŨÉŦģÁĩíĩÄĘĮNa2CO3;ŌēŋÉĀûÓÃâów·Ļ�����ĄĢĩΞÓÏĄû}ËáĢŽÁĒžīŪa(chĻĢn)ÉúâÅÝĩÄĘĮNaHCO3�ĢŽé_Ęžo(wĻē)âÅÝŪa(chĻĢn)ÉúĩÄĘĮNa2CO3ĄĢ
(2)Na2CO3����ĄĒNaHCO3šÍû}ËáĩÄ·īŠ(yĻĐng)
Na2CO3ČÜŌššÍÏĄû}Ëá·īŠ(yĻĐng)ŋÉĀí―âé·Öē―·īŠ(yĻĐng)Ģš
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3ČÜŌššÍÏĄû}Ëá·īŠ(yĻĐng)ĩÄŧŊW(xuĻĶ)·―ģĖĘ―é
NaHCO3+HCl===NaCl+CO2↑+H2O
ĒŲ·ÅģöCO2ĩÄËŲÂĘ
NaHCO3ČÜŌšÅcû}Ëá·īŠ(yĻĐng)·ÅģöCO2ĩÄËŲÂĘŋėĄĢ
ĒÚNa2CO3ČÜŌšÅcû}ËáĩÄŧĨĩÎčbe
ÏōNa2CO3ČÜŌšÖÐÖðĩΞÓČëû}Ëá�ĢŽé_Ęžo(wĻē)âÅÝŪa(chĻĢn)ÉúĢŽķøÏōû}ËáÖÐĩΞÓNa2CO3ČÜŌš��ĢŽé_ĘžūÍÓÐâÅÝŪa(chĻĢn)Éú��ĄĢ
ĒÛCO2ÉúģÉÁŋąČÝ^
a.ĩČÎïŲ|(zhĻŽ)ĩÄÁŋĩÄNa2CO3����ĄĒNaHCO3·ÖeÅcŨãÁŋĩÄû}Ëá·īŠ(yĻĐng)ĢŽŪa(chĻĢn)ÉúĩÄCO2ÏāĩČ�ĄĢ
b.ĩČŲ|(zhĻŽ)ÁŋĩÄNa2CO3ĄĒNaHCO3·ÖeÅcŨãÁŋĩÄû}Ëá·īŠ(yĻĐng)���ĢŽNaHCO3Ūa(chĻĢn)ÉúĩÄCO2ķāĄĢ
c.ĩČÁŋĩÄû}ËáÅcŨãÁŋĩÄNa2CO3���ĄĒNaHCO3·Öe·īŠ(yĻĐng)�ĢŽNaHCO3Ūa(chĻĢn)ÉúĩÄCO2ķāĄĢ
d.ŌŧķĻÁŋĩÄNaHCO3ĘÜá·Ö―âŪa(chĻĢn)ÉúĩÄCO2ÁŋÅcĘÜá·Ö―âšóĩÄÁôÎïÅcû}Ëá·īŠ(yĻĐng)Ūa(chĻĢn)ÉúĩÄCO2ÁŋÏāĩČ����ĄĢ
5.ĩ(shĻī)ÐÎ―Y(jiĻĶ)šÏËžÏëĀí―âNa2CO3ĄĒNaHCO3Åcû}ËáĩÄ·īŠ(yĻĐng)
(1)û}ËáÖðĩΞÓČëNa2CO3ČÜŌšÖÐ(û}ËáēŧŨãr(shĻŠ))
ĒŲŽF(xiĻĪn)ÏóĢšé_Ęžo(wĻē)Ãũï@ŽF(xiĻĪn)Ïó�ĢŽšóÓÐo(wĻē)ÉŦâów·ÅģöĄĢ
ĒÚ·īŠ(yĻĐng)Ģšo(wĻē)Ãũï@ŽF(xiĻĪn)Ïór(shĻŠ)·īŠ(yĻĐng)ĩÄëxŨÓ·―ģĖĘ―ĢšCO3(2-)+H+===HCO3(-)����ĢŽÓÐo(wĻē)ÉŦâów·Åģör(shĻŠ)·īŠ(yĻĐng)ĩÄëxŨÓ·―ģĖĘ―ĢšHCO3(-)+H+===CO2↑+H2OĄĢ
(2)Na2CO3ČÜŌšÖðĩΞÓČëÏĄû}ËáÖÐ(û}Ëáß^(guĻ°)Áŋr(shĻŠ))
ĒŲŽF(xiĻĪn)ÏóĢšÓÐo(wĻē)ÉŦâów·Åģö��ĄĢčbeNa2CO3�ĄĒNaHCO3ĩÄģĢÓ÷―·Ļ
ĒÚ·īŠ(yĻĐng)ĩÄëxŨÓ·―ģĖĘ―ĢšCO3(2-)+2H+===CO2↑+H2OĄĢ
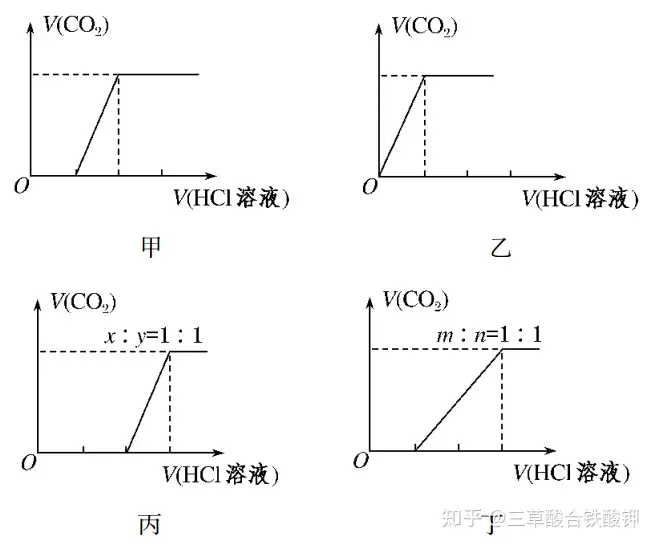
(3)ĖžËáâc���ĄĒĖžËáäâcÅcû}Ëá·īŠ(yĻĐng)ĩÄŧųąūDÏó
ĒŲÏōNa2CO3ÖÐÖðĩΞÓČëû}Ëá�����ĢŽÏûšÄHClČÜŌšĩÄów·eÅcŪa(chĻĢn)ÉúCO2ĩÄów·eĩÄęP(guĻĄn)ÏĩČįDžŨËųĘū�����ĄĢ
ĒÚÏōNaHCO3ÖÐÖðĩΞÓČëû}Ëá��ĢŽÏûšÄHClČÜŌšĩÄów·eÅcŪa(chĻĢn)ÉúCO2ĩÄów·eĩÄęP(guĻĄn)ÏĩČįDŌŌËųĘū�ĄĢ
ĒÛÏōNaOHĄĒNa2CO3ĩÄŧėšÏÎïÖÐÖðĩΞÓČëû}Ëá�ĢŽÏûšÄHClČÜŌšĩÄów·eÅcŪa(chĻĢn)ÉúCO2ĩÄów·eĩÄęP(guĻĄn)ÏĩČįDąûËųĘū(ÔO(shĻĻ)NaOHĄĒNa2CO3ĩÄÎïŲ|(zhĻŽ)ĩÄÁŋÖŪąČéxĄÃy=1ĄÃ1���ĢŽÆäËûąČĀýr(shĻŠ)ĩÄDÏóÂÔ)��ĄĢ
ĒÜÏōNa2CO3�����ĄĒNaHCO3ĩÄŧėšÏÎïÖÐÖðĩΞÓČëû}Ëá�����ĢŽÏûšÄHClČÜŌšĩÄów·eÅcŪa(chĻĢn)ÉúCO2ĩÄów·eĩÄęP(guĻĄn)ÏĩČįDķĄËųĘū(ÔO(shĻĻ)Na2CO3����ĄĒNaHCO3ĩÄÎïŲ|(zhĻŽ)ĩÄÁŋÖŪąČémĄÃn=1ĄÃ1��ĢŽÆäËûąČĀýr(shĻŠ)ĩÄDÏóÂÔ)���ĄĢ
čbeNa2CO3��ĄĒNaHCO3ĩÄģĢÓ÷―·Ļ

ĄĄĄĄ gÓĘđÓÃĘÖC(jĻĐ)�����ĄĒÆ―°åĩČŌÆÓ(dĻ°ng)ÔO(shĻĻ)äÔL(wĻĻn)ÖÐŋžūW(wĻĢng)���ĢŽ2023ÖÐŋžŌŧ·Åã°éÍŽÐÐĢĄ>>üc(diĻĢn)ôēéŋī


















